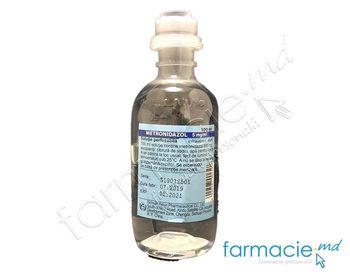
METRONIDAZOL |
DENUMIREA COMERCIALĂ Metronidazol DCI-ul substanţei active Metronidazolum COMPOZIŢIA 100 ml soluţie conţine: substanţă activă: metronidazol - 500 mg; excipienţ: clorură de sodiu, apă pentru injecţii. FORMA FARMACEUTICĂ Soluţie perfuzabilă. DESCRIEREA MEDICAMENTULUI Soluţie transparentă, de la practic incoloră la galben pal. GRUPA FARMACOTERAPEUTICĂ şi codul ATC Preparate antibacteriene pentru uz sistemic, derivaţi de imidazol; J01XD01. PROPRIETĂŢILE FARMACOLOGICE Proprietăţi farmacodinamice Metronidazolul reprezintă un derivat de nitroimidazol si posedă proprietăţi antiinfecţioase, în special asupra anaerobilor obligatorii, Trichomonas vaginalissi alte protozoare (inclusiv Entamoeba histolyticasi Giardia lamblia). Se presupune că aceste proprietăţi sunt datorate interacţiunilor cu ADN si cu diferiţi metaboliţi. Spectrul de acţiune Microorganisme sensibile la metronidazol •aerobi gram-negativi; Helicobacter pylori; •anaerobi; Bacteroides fragilis, Bifidobacterium spp. , Bilophila spp. , Clostridium spp. (Clostridium difficile, Clostridium perfringens), Eubacterium spp. , Fusobacterium spp. , Peptostreptococcus spp. , Prevotella spp. , Porphyromonas spp. , Veillonella spp. Microorganisme rezistente la metronidazol: •aerobi gram-pozitivi: Actinomyces spp. ; •anaerobi: Mobiluncus spp. , Propionibacterium acnes. Metronidazolul posedă activi tate antiparazitară contra următoarelor specii de microorganisme: Entamoeba histolytica, Giardia intestinalis, Trichomonas vaginalis. Metronidazolul manifestă rezistenţă încrucişată cu tinidazolul. Proprietăţi farmacocinetice Distribuţie Administrarea unei doze unice de 500 mg de metronidazol în perfuzie intravenoasă, timp de 20 minute, determină o concentraţie plasmatică medie de 14-18 pg/ml la |
sfârşitul perfuziei. După administrarea intravenoasă a unei doze unice de 1000 mg, concentraţia plasmatică maximă a 2-hidroxi-metabolitului alcătuieşte 3 |jg/ml. Concentraţia plasmatică medie a metronidazolului la administrări repetate, peste fiecare 8 sau 12 ore, reprezintă 17 jg/ml şi 13 jg/ml, respectiv. Metronidazolul se leagă de proteinele plasmatice în proporţie de aproximativ 10%, iar volumul de distribuţie alcătuieşte 1,1 ± 0,4 l/kg. Biotransformare Metronidazolul este metabolizat în ficat prin hidroxilare, oxidare şi glucuronoconjugare. Metaboliţii principali sunt 2-hidroxi-metabolit şi un metabolit acetat. Eliminare Peste 50% din doza administrată este excretată în urină, sub formă nemodificată (aproximativ 20% din doza) sau sub formă de metaboliţi. Aproximativ 20% din doză este eliminată cu masele fecale. Clearence-ul metronidazolului alcătuieşte 1,3 ± 0,3 ml/minut/kg, în timp ce clearence-ul renal alcătuieşte aproximativ 0,15 ml/minut/kg. Timpul de înjumătăţire plasmatică al metronidazolului alcătuieşte circa 8 ore, iar cel al 2-hidroxi-metabolitului - circa 10 ore. Categorii speciale de pacienţi Timpul de înjumătăţire plasmatică al metronidazolului nu este influenţat de insuficienţa renală, însă cel al 2-hidroxi-metabolitului şi metabolitului acetat pot fi crescute. In cadrul hemodializei metronidazolul este rapid excretat, iar timpul de înjumătăţire plasmatică scade până la 2,5 ore. Dializa peritoneală nu pare să afecteze eliminarea metronidazolului sau a metaboliţilor săi. La pacienţii cu insuficienţă hepatică, este posibilă descreşterea metabolizării metronidazolului, ceea ce duce la o creştere a timpului de înjumătăţire plasmatică. La pacienţii cu insuficienţă hepatică severă, clearance-ul preparatului poate fi redus până la circa 65%, ceea ce duce la o acumulare a metronidazolului în organism. INDICAŢII TERAPEUTICE Tratamentul infecţiilor anaerobe Administrarea preparatului este indicată în tratamentul infecţiilor grave cauzate de bacterii anaerobe sensibile. Paralel cu administrarea preparatului, în unele cazuri sunt indicate proceduri chirurgicale. În cazul unei infecţii mixte (aerobă şi anaerobă), este necesar de a combina administrarea metronidazolului cu un antibiotic adecvat pentru tratamentul infecţiei aerobe. Preparatul este eficient în infecţiile cu Bacteroides fragilis, rezistente la clindamicină, cloramfenicol şi penicilină. Preparatul este indicat în: -infecţii intra-abdominale, inclusiv peritonite, abcese intra-abdominale şi abces hepatic, provocate de specii din genul Bacteroides, inclusiv grupul B. fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium spp. , Eubacterium spp. , Peptococcus spp. şi Peptostreptococcus spp. ; -infecţii cutanate şi ale structurilor subcutanate, provocate de Bacteroides spp. , inclusiv grupul B. fragilis, Clostridium spp. , Peptococcus spp. , Peptostreptococcus spp. şi Fusobacterium spp. ; -infecţii ginecologice, inclusiv endometrită, endomiometrită, abces tubo-ovarian şi infecţie postoperatorie a plăgii vaginale, provocate de Bacteroides spp. , inclusiv grupul B. fragilis, Clostridium spp. , Peptostreptococcus spp. şi Fusobacterium spp. ; -septicemie bacteriană, provocată de Bacteroides spp. , inclusiv grupul B. fragilis şi Clostridium spp. ; -infecţii ale oaselor şi articulaţiilor (ca terapie adjuvantă), provocate de Bacteroides spp. , inclusiv grupul B. fragilis; -infecţii ale sistemului nervos central (SNC), inclusiv meningită şi abces cerebral, provocate de Bacteroides spp. , inclusiv grupul B. fragilis; |
-infecţii ale căilor respiratorii inferioare, inclusiv pneumonie, empiem si abces pulmonar, provocate de Bacteroides spp. , inclusiv grupul B. fragilis; -endocardită, provocată de Bacteroides spp. , inclusiv grupul B. fragilis. Profilaxie Administrarea profilactică, preoperatorie, intraoperatorie si postoperatorie a preparatului poate reduce incidenţa infecţiei postoperatorii la pacienţii supusi unei intervenţii chirurgicale colorectale elective, care este considerată o intervenţie contaminată sau potenţial contaminată. Utilizarea profilactică ^a preparatului trebuie întreruptă în termen de 12 după intervenţia chirurgicală. În cazul în care sunt depistate semne ale infecţiei, este necesar de a colecta mostre de culturi, de a efectua analizele de laborator necesare pentru identificarea microorganismului cauzal si selectarea unui antibiotic adecvat. Pentru a reduce dezvoltarea bacteriilor rezistente la medicamente si pentru a menţine eficienţa metronidazolului si a altor substanţe antibacteriene, preparatul trebuie folosit doar pentru a trata sau preveni infecţiile cauzate de bacterii sensibile. Când sunt disponibile informaţii privind identitatea si sensibilitatea microorganismului, acestea vor fi luate în considerare la selectarea sau modificarea tratamentului antibacterian. În absenţa unor astfel de date, modelele locale epidemiologie pot contribui la selectarea empirică a tratamentului. DOZE ŞI MOD DE ADMINISTRARE Profilaxia infecţiilor chirurgicale Dre/post-operatorii Preparatul va fi utilizat preponderent în cadrul intervenţiilor chirurgicale abdominale (in special colorectale) si ginecologice. Durata profilaxiei trebuie să fie scurtă, limitată în mare parte la perioada post- operativă (24 de ore, dar nu mai mult de 48 de ore). Sunt posibile diverse scheme de administrare a preparatului. Adulţi: o doză unică de 1000 - 1500 mg, cu 30 - 60 de minute înainte de intervenţie sau, alternativ, 500 mg imediat înainte, în timpul sau după intervenţie, iar apoi câte 500 mg la fiecare 8 ore. Copii: o doză unică de 20 - 30 mg/kg, cu 30 - 60 de minute înainte de intervenţie sau, alternativ, 7,5 mg/kg imediat înainte, în timpul sau după intervenţie, iar apoi câte 500 mg la fiecare 8 ore. Nou-născuai prematuri, cu vârsta gestaaonală mai mică de 40 săptămâni: o singură doză de 10 mg/kg masă corporală înainte de intervenţie. Vârstnici: se recomandă prudenţă la vârstnici, în special la administrarea dozelor mari; totodată, există informaţii limitate cu privire la modificarea dozei. Tratamentul infecţiilor cauzate de bacterii anaerobe. Calea intravenoasă se va utiliza iniţial, în cazul pacienţilor, simptomatica cărora exclude tratamentul pe cale orală. Sunt posibile diverse scheme de administrare a preparatului. Adulţi: 1000 - 1500 mg pe zi în doză unică sau, alternativ, 500 mg la fiecare 8 ore. Copii: 20 - 30 mg/kg/zi în doza unică sau, alternativ, 3 doze de 7,5 mg/kg, administrate la fiecare 8 ore. Nou-născuai cu vârsta până la 8 săptămâni: o doză mai mică de 15 mg/kg o dată pe zi sau 7,5 mg/kg la fiecare 12 ore. Nou-născuai prematuri, cu vârsta gestaţională mai mică de 40 săptămâni: În prima săptămână de viaţă este posibilă acumularea preparatului în organism. De aceea, după câteva zile de tratament este necesar de a controla concentraţiile plasmatice ale metronidazolului. Vârstnici: se recomandă prudenţă la vârstnici, în special la administrarea dozelor mari; totodată, există informaţii limitate cu privire la modificarea dozei. Transferul la administrarea perorală a metronidazolului trebuie realizat cât mai curând posibil si poate fi efectuat păstrând acelaşi regim de dozare. |
Durata tratamentului |
Un tratament cu durata de 7-10 zile de obicei este suficient pentru majoritatea pacienţilor. Însă, în funcţie de evaluările clinice si bacteriologice, medicul ar putea decide să prelungească tratamentul, de exemplu pentru eradicarea infecţiei din regiunile care nu pot fi drenate sau sunt susceptibile de a recontamina endogen cu patogeni anaerobi din intestin, orofaringe sau tractul genital. Pacienţi cu insuficientă renală Ajustările de rutină ale dozei de metronidazol nu sunt considerate necesare în prezenţa insuficienţei renale. Nu este necesară ajustarea de rutină a dozei de metronidazol la pacienţii cu insuficienţă renală supusi dializei peritoneale intermitentă (DPI) sau dializei peritoneale ambulatorie continuă (DPAC). Cu toate acestea, reducerea dozei poate fi necesară atunci când se determină concentraţii excesive de metaboliţi. La pacienţii hemodializaţi, preparatul trebuie re-administrat imediat după hemodializă. Pacienţii cu insuficienţă hepatică avansată La pacienţii cu insuficienţă hepatică avansată este necesară o reducere a dozei, cu monitorizarea nivelului plasmatic al metronidazolului. Mod de administrare Parenteral, intravenos, cu o rată de perfuzare de aproximativ 5 ml/minut (1 container timp de 20-60 minute). Cât mai curând posibil este necesar de a efectua transferul la forme perorale de metronidazol. Containerele sunt de unică folosinţă. A se arunca orice cantitate neutilizată de preparat. A nu se reutiliza containerele utilizate parţial. Orice produs neutilizat sau material rezidual trebuie eliminat în conformitate cu reglementările locale. REACŢII ADVERSE Următoarea convenţie a fost utilizată pentru clasificarea reacţiilor adverse în funcţie de frecvenţă: foarte frecvente (>1/10), frecvente (>1/100 şi <1/10), mai puţin frecvente (>1/1000 şi <1/100), rare (>1/10000 şi <1/1000), foarte rare (<1/10000J, şi cu frecvenţă necunoscută (care nu poate fi estimată din datele disponibile). În fiecare grup de frecvenţă, reacţiile adverse sunt trecute în ordinea descrescătoare a gravităţii lor. Reacţiile adverse menţionate mai jos au fost raportate în perioada post-marketing, de aceea posedă o frecvenţă necunoscută: Tulburări hematologice si limfatice: eozinofilie tranzitorie si leucopenie. Tulburări cardiace: palpitaţii si dureri în piept. Tulburări oculare: neuropatie optică. Tulburări gastrointestinale: diaree, greaţă, vomă, anorexie, tulburări epigastrice, dispepsie, constipaţie si cazuri rare de colită pseudomembranoasă. De asemenea, au fost comunicate cazuri de limbă saburată, xerostomie, gust metalic neplăcut. Tulburări generale si la nivelul locului de administrare: ataxie tranzitorie, înrosirea ocazională feţei si cefalee, mai ales în caz de ingestie concomitentă de alcool, alterarea gustului băuturilor alcoolice. Tulburări metabolice si de nutriţie: de către unii cercetători a fost raportat dezvoltarea unui efect antitiroidian, însă trei studii clinice diferite nu a reuşit să confirme acest lucru. Tulburări ale sistemului nervos: encefalopatie, meningită aseptică, crize convulsive, neuropatie periferică, cefalee si ameţeli. La câţiva pacienţi, care au administrat doze perorale moderat-înalte sau înalte de metronidazol timp îndelungat, s-au dezvoltat neuropatii periferice. Se pare că aceste reacţii adverse nu sunt direct asociate cu doza zilnică de metronidazol. Un factor |
predispozant important este continuarea administrării perorale şi/sau intravenoase a medicamentului timp de câteva săptămâni sau luni. Au fost raportate, de asemenea, tulburări neurologice profunde, după 2 ore de la administrarea metronidazolului. Apariţia acestora nu este asociată direct cu regimul de dozare. Tulburări psihice: somnolenţă si insomnie. Tulburări renale şi ale căilor urinare: disurie. A fost raportată întunecarea urinei. Acest lucru se datorează, probabil, unui metabolit al metronidazolului si nu pare a avea vreo semnificaţie clinică. De asemenea, a fost raportată micşorarea reversibilă a concentraţiei lipidelor serice. Tulburări ale aparatului genital şi sânului: proliferarea infecţiilor vaginale cu Candida albicans,senzaţie de uscaciune şi ardere a mucoasei vaginale. A fost raportat un singur caz de ginecomastie, care s-a rezolvat la întreruperea administrării metronidazolului. Afecţiuni cutanate şi ale ţesutului subcutanat: Sindromul Stevens Johnson, necroliză epidermică toxică, erupţie cutanată, şi prurit. Tulburări vasculare:tromboflebită (la administrarea intravenoasă a metronidazolului). CONTRAINDICAŢII Preparatul este contraindicat la pacienţii cu antecedente de hipersensibilitate la metronidazol sau alţi derivaţi de nitroimidazol, sau la oricare dintre excipienţi. Metronidazol este contraindicat în primul trimestru de sarcină. Utilizarea metronidazolului este contraindicată la pacienţii cu leziuni hepatice în stadiu terminal, tulburări hematopoietice şi maladii necontrolate ale sistemului nervos central sau periferic. SUPRADOZAJ Simptome În caz de supradozaj la adulti, simptomele clinice sunt de obicei limitate la greaţă, vomă, ataxie şi senzaţie uşoară de dezorientare. La nou-născuţii prematuri nu a fost determinată dezvoltarea semnelor clinice sau biologice de toxicitate. Tratament Nu exista nici un tratament specific pentru supradozajul cu metronidazol. În caz de supradozaj, administrarea preparatului trebuie sistată, iar pacienţii trebuie trataţi simptomatic. ATENŢIONĂRI ŞI PRECAUŢII SPECIALE DE UTILIZARE Maladii hepatice Metronidazolul este metabolizat în principal prin oxidare hepatică. În cazul insuficienţei hepatice avansate, se poate produce dereglarea clearance-ului metronidazolului. La aceşti pacienţi, pentru a trata trichomoniaza, este necesar de a evalua cu atenţie raportul risc/beneficiu. Concentraţiile plasmatice ale metronidazolului trebuie monitorizate cu precauţie. Maladii ale sistemului nervos central în stadiu activ Metronidazol trebuie utilizat cu precauţie la pacienţii cu maladii active ale sistemului nervos central. Tratamentul trebuie întrerupt în caz de ataxie, ameţeli sau confuzie. În cazul pacienţilor care suferă de boli neurologice centrale şi periferice severe, parestezii şi epilepsie (fixă sau progresivă) trebuie să fie luat în considerare riscul de agravare a stării neurologice. Este necesară prudenţă la pacienţii cu maladii ale sistemului nervos central în stadiul activ, cu excepţia abcesului cerebral. Afecţiuni renale Metronidazolul este îndepărtat în timpul hemodializei şi trebuie să fie re-administrat după ce procedura a luat sfârşit terminat. |
Pacienţii care urmează un regim controlat de sodiu Preparatul poate afecta pacienţii care urmează o dietă hiposodică. Alcool Pacienţii trebuie sfătuiţi să nu consume alcool în timpul tratamentului cu metronidazol si cel puţin 48 de ore după aceasta, din cauza dezvoltării efectului disulfiramic (înroşirea feţei, vomă, tahicardie). Terapie intensivă sau prelungită cu metronidazol De regulă, durata obişnuită a tratamentului intravenos cu metronidazol sau alţi derivaţi de imidazol alcătuieşte mai puţin de 10 zile. Acest termen poate fi depăşit numai în cazuri individuale, după o evaluare foarte strictă a raportului beneficiu/risc. Tratamentul se va repeta doar în cele mai rare cazuri. Limitarea duratei tratamentului este necesară deoarece nu poate fi exclusă deteriorarea celulelor embrionare umane. Terapia intensivă sau prelungită cu metronidazol trebuie efectuată numai în condiţii de monitorizare a parametrilor clinici şi biologici şi sub supraveghere de specialitate. În cazul în care este necesar tratament prelungit, medicul trebuie să ia în consideraţie posibilitatea dezvoltării neuropatiei periferice sau a leucopeniei. Ambele efecte sunt de obicei reversibile. În caz de tratament prelungit, trebuie să fie monitorizată apariţia reacţiilor adverse, cum ar fi parestezii, ataxie, ameţeli şi crize convulsive. Regimul de dozare care presupune administrarea dozelor mari de preparat a fost asociat cu dezvoltarea crizelor epileptiforme tranzitorii. Monitorizare Monitorizarea clinică regulată şi monitorizarea de laborator periodică (inclusiv analiza formulei leucocitare) se recomandă în cazul administrării dozelor mari sau în tratamentul prelungit, în caz de antecedente de discrazie a sângelui, în caz de infecţii severe şi în insuficienţă hepatică severă. Recomandări generale Pacienţii trebuie avertizaţi că preparatul poate întuneca la culoare urina (datorită metaboliţilor metronidazolului). Administrarea în sarcină şi perioada de alăptare Datele clinice cu privire la un număr mare de sarcini expuse şi datele obţinute la animale nu au indicat efecte teratogene sau fetotoxice. Cu toate acestea, administrarea nelimitată de nitroimidazolene de către mamă poate fi asociată cu un risc cancerigen sau mutagen pentru făt sau nou-născut. Prin urmare, preparatul nu trebuie administrat în timpul sarcinii decât dacă este absolut necesar. Metronidazol este contraindicat în primul trimestru de sarcină. Metronidazol este excretat în laptele matern. În perioada de alăptare este necesar de a sista tratamentul sau de a întrerupe alăptarea. Influenţa asupra capacităţii de a conduce vehicule sau de a folosi utilaje Nu au fost efectuate studii de determinare a influenţei metronidazolului asupra capacităţii de a conduce vehicule şi de a folosi utilaje. De aceea, nu se recomandă pacienţilor să conducă vehicule sau să folosească utilaje. INTERACŢIUNI CU ALTE MEDICAMENTE, ALTE TIPURI DE INTERACŢIUNI Nu se recomandă tratament concomitent cu: Alcoolul: efect disulfiramic (senzaţie de căldură, roşeaţă, vomă, tahicardie). Trebuie să fie evitate băuturile alcoolice şi medicamentele care conţin alcool. Pacienţii trebuie sfătuiţi să nu consume alcool în timpul tratamentului cu metronidazol şi cel puţin 48 de ore după aceasta, din cauza dezvoltării efectului disulfiramic (înroşirea feţei, vomă, tahicardie). Terapie concomitentă care necesită măsuri speciale de precauţie: Anticoagulantele orale (warfarina): sporirea efectului anticoagulantelor orale şi creşterea riscului de hemoragie (scăderea catabolismului hepatic a acestor substanţe). Timpul de protrombină trebuie monitorizat mai frecvent. Doza de anticoagulante orale |
trebuie ajustată pe parcursul tratamentului cu metronidazol si timp de 8 zile de la retragerea acestuia. Un număr mare de pacienţi Au raportat o creştere a activi tăţii anticoagulantelor orale pe parcursul tratamentului concomitent cu antibiotice. Factorii de risc în acest context sunt: statutul infecţios şi inflamator a pacientului, vârsta şi starea generală a acestuia. Totodată, în apariţia tulburărilor timpului de protrombină, nu este clar rolul jucat de maladia în sine şi de tratamentul acesteia. Unele clase de antibiotice duc cu o probabilitate sporită la această interacţiune, în special fluorochinolonele, macrolidele, ciclinele, co-trimoxazolul şi anumite cefalosporine. Vecuroniu (curaremimetic nedepolarizant): metronidazolul poate potenţa efectele vecuroniului. Asocieri care trebuie luate în considerare: 5-fluorouracilul: creşterea toxicităţii 5-fluorouracilului datorită scăderii clearance-ului acesteia. Litiu: la pacienţii trataţi concomitent cu litiu şi metronidazol a fost raportată retenţia litiului în organism, însoţită de dovezi de eventuale leziuni renale. Este necesar ca tratamentul cu litiu să fie redus sau retrasă înainte de administrarea metronidazolului. La pacienţii care administrează concomitent preparate de litiu şi metronidazol este necesar de a monitoriza concentraţiile plasmatice ale litiului, creatininei şi electroliţilor. Barbiturice: fenobarbitalul ar putea induce metabolismulul metronidazolului, care ar putea duce la scăderea eficacităţii acestuia. Colestiramina poate întârzia sau reduce absorbţia metronidazolului. Administrarea concomitentă de fenitoină şi metronidazol poate afecta metabolismul preparatului. Cimetidina inhibă metabolizarea metronidazolului. Ciclosporina: unele rapoarte de caz demonstrează că tratamentul concomitent cu metronidazol şi ciclosporină ar putea duce la creşterea concentraţiilor plasmatice ale ciclosporinei. Este necesar de a monitoriza concentraţiile plasmatice ale ciclosporinei şi a creatininei. Teste de laborator: metronidazolul poate imobiliza treponemele şi astfel poate duce pozitivarea falsă a testului Nelson. Incompatibilităţi Preparatul nu trebuie amestecat cu cefamandol nafat, cefoxitina de sodiu, soluţia de dextroză 10%, soluţie Hartmann sau sarea de potasiu a penicilinei G. PREZENTARE, AMBALAJ Soluţie perfuzabilă 5 mg/ml. Câte 100 ml de soluţie perfuzabilă în ambalaj din sticlă incoloră cu dop din cauciuc, capac din aluminiu şi masă plastică, cu închidere flip-off. PĂSTRARE A se păstra la loc ferit de lumină, la temperaturi sub 25°C. A nu se lăsa la îndemâna şi vederea copiilor! TERMEN DE VALABILITATE 3 ani. A nu se utiliza după data de expirare indicată pe ambalaj. STATUTUL LEGAL Cu prescripţie medicală. DATA ULTIMEI REVIZUIRI A TEXTULUI Decembrie 2014. DEŢINĂTORUL CERTIFICATULUI DE ÎNREGISTRARE. NCPC International Corp. China, |
NUMELE ŞI ADRESELE PRODUCĂTORILOR. Hebei Tiancheng Pharmaceutical Co. , Ltd. Add. : No. 18, Jinguang Road Street Avenue, Economic&Technological Development Zone, Cangzhou City, Hebei Province, P. R. China, 061000 Tel. : +86-317-7883289 Fax: +86-317-7883006 |